I. Mục đích lấy khí máu động mạch (arterial blood gas-ABC):
+ Chỉ định (4):
- Chẩn đoán rối loạn thăng bằng kiềm-toan (alkalosis-acidosis).
- Đánh giá đáp ứng điều trị.
- Suy hô hấp.
- Hỗ trợ tiên lượng các bệnh nặng.
+ Chống chỉ định (5):
- Động mạch khó bắt, khó định vị.
- Thông nối động tĩnh mạch.
- Ổ nhiễm trùng gần nơi muốn lấy.
- Nghiệm pháp Allen âm tính.
- Rối loạn đông máu.
II. Thực hiện lấy khí máu động mạch:
1/ Vị trí cần lấy:
+ Theo độ đơn giản từ cao đến thấp: động mạch đùi
(to) -> động mạch cánh tay -> động mạch quay (nhỏ).
+ Theo độ an toàn (thực tế lâm sàng) từ cao đến thấp: động mạch quay -> động mạch cánh tay -> động mạch đùi.

Source: https://www.slideshare.net/lekhacthienluan/gii-phu-vng-chi-trn
Tổn thương thần kinh là một biến chứng có thể gặp khi thực hiện lấy khí máu ở động mạch cánh tay hay đùi. Ngoài ra, huyết khối vẫn là biến chứng thường gặp nhất bên cạnh thuyên tắc khí do thực hiện thao tác nhiều lần.
2/ Test Allen:
Lý do động mạch quay là vị trí thường dùng để lấy khí máu động mạch là do nếu động mạch quay (radial artery) bị tắc trong quá trình thực hiện (xuất hiện huyết khối) thì ở điều kiện bình thường, gan tay vẫn được nhận máu từ động mạch trụ (ulnar artery). Ngược lại, nếu động mạch trụ bị tắc thì việc thực hiện bị chống chỉ định. Do đó test Allen cần được thực hiện trước khi lấy khí máu động mạch. Đây là một nghiệm pháp nhằm kiểm tra khả năng động mạch trụ cung cấp máu cho gan tay trong trường hợp động mạch quay bị tắc.

Source: https://quizlet.com/192016727/test
Quy trình thực hiện test Allen:
+ Bước 1: Hướng dẫn bệnh nhân nắm chặt tay để giảm lưu lượng máu xuống bàn tay.
+ Bước 2: Dùng ngón trỏ và ngón giữa ấn mạnh vào đường đi của động mạch quay và động mạch trụ. Giữ vài giây.
+ Bước 3: Người thực hiện test giữ nguyên tay, yêu cầu bệnh nhân thả lỏng tay và để tay thoải mái. Quan sát bàn tay bệnh nhân trắng bệch vì giảm máu tới nuôi.
+ Bước 4: Thả ngón tay ấn động mạch trụ và giữ nguyên ngón tay ấn động mạch quay. Nếu bàn tay hồng hào trở lại trong 7-10s trở xuống thì nghiệm pháp dương tính (máu từ động mạch trụ lưu thông tốt). Nếu bàn tay hồng lại rất chậm thì nghiệm pháp âm tính. Tiến hành kiểm tra ở tay còn lại.
III. Một số chỉ số khí máu động mạch thường dùng cùng khoảng bình thường:
- pH: 7,35-7,45.
- PaCO2: 35-45 mmHg.
- HCO3-: 22-26 mEq/l.
- SaO2 (độ bão hòa oxy trong máu động mạch – arterial oxygen saturation): 95-100%.
- PaO2 (áp suất riêng phần của oxy trong máu động mạch – pressure of arterial oxygen): 80-100mmHg.
Người ta thường viết tắt theo thứ tự là pH/PaCO2/PaO2/HCO3-. Ví dụ: 7,40/40/85/24
IV. Phân tích SaO2 và PaO2:
1/ Ý nghĩa:
Ta biết rằng oxy trong máu tồn tại chủ yếu dưới hai dạng: hòa tan/ tự do (khoảng 1,5%) và gắn với hemoglobin (khoảng 98,5%).

Source: https://www.slideshare.net/onikhil789/transport-of-oxygen-and-carbon-dioxide
PaO2 chính là áp suất riêng phần của oxy tự do trong máu động mạch.

Source: http://thietbiytevietmy.vn/khac-biet-pao-2-sao-2-va-ham-luong-oxy
SaO2 chính là phần trăm hemoglobin có gắn oxy trong máu động mạch.
2/ Liên quan giữa SaO2 và PaO2:
Do bản chất PaO2 liên quan đến lượng oxy tự do trong máu (để đi được vào mô), SaO2 liên quan đến lượng hemoglobin gắn với oxy nên mối liên quan giữa PaO2 và SaO2 bản chất chính là liên quan giữa phân áp oxy ở mô và độ bão hòa oxy trong hemoglobin, vốn được thể hiện rõ qua một đường cong có dạng sigma: đường cong Barcroft (hemoglobin saturation curve/ oxygen dissociation curve):

Source: http://oxygengerufuku.blogspot.com/2017/02/oxygen-hemoglobin-dissociation-curve.html
Trục hoành của biểu đồ trên thể hiện phân áp oxy ở mô (oxy phải ở dạng tự do mới vào mô được) trong khi trục tung thể hiện độ bão hòa oxy máu (nhưng từ đó ta sẽ tập trung vào lượng oxy được nhả ra). Đường đi của đường cong từ trái sang phải tương ứng với trên trục hoành đi từ mô đến phổi.
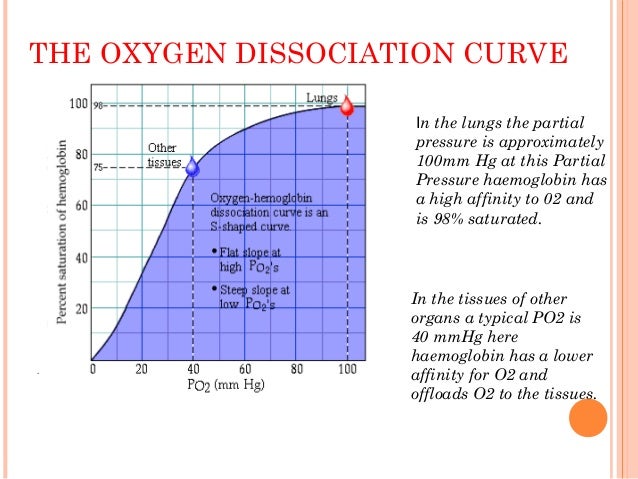
Source: https://www.slideshare.net/DivyaJain229/oxygen-dissociation-curve-78084004
Tại mô, nơi có PaO2 khoảng 40mmHg, đường cong khá dốc, trong khi ở phổi, nơi có PaO2 khoảng 100mmHg, đường cong lại tà hơn (dạng plateau).
Chẳng hạn một người bình thường có PaO2 ở mô là 40mmHg, nhưng vì lí do gì đó mà tụt xuống 20mmHg, tức giảm 20mmHg. Chiếu trên đồ thị thì SaO2 người này đã giảm từ 75% đến khoảng 36%, tức giảm 39% SaO2 hay tăng 39% oxy tự do. Ngược lại, ở phổi, sự tăng PaO2 từ 80mmHg lên 100mmHg chỉ làm tăng sự gắn oxy vào hemoglobin tăng rất nhẹ, từ khoảng 96% lên 100%. Điều này cho thấy hemoglobin có tính đệm oxy rất tốt: lấy oxy tối đa tại phổi và phân phối oxy tối đa tại mô.
Nói chung, dù ở phổi hay ở mô thì PaO2 tăng thường đi kèm với SaO2 tăng và ngược lại. Tuy nhiên, 2 ngoại lệ có thể xảy ra ở một số bệnh nhân hồng cầu bất thường về cấu trúc hoặc heme có gắn chặt chẽ với một số thành phần bất thường (chẳng hạn các dạng MetHb hay CO-Hb). Trong các trường hợp này, PaO2 nếu có tăng, tức O2 hòa tan tăng thì lượng O2 này cũng không thể gắn vào nhân heme trong hemoglobin, do đó SaO2 không tăng. Tuy nhiên các trường hợp này tương đối hiếm gặp trên lâm sàng.
V. Phân biệt SaO2 và SpO2:
SpO2 cũng là một chỉ số thể hiện độ bão hòa oxy máu, tuy nhiên nếu SaO2 đo được bằng phương pháp xâm lấn (lấy khí máu động mạch) thì SpO2 lại có thể đo được bằng phương pháp ít xâm lấn hơn, qua máy đo độ bão hòa oxy máu theo mạch đập (pulse oximeter) hoặc đầu dò (probe) của Monitor.

Source: https://www.gearbest.com/monitoring-testing/pp_415641.html
Nguyên tắc của pulse oximeter dựa trên:
+ Sắc ký (phép đo quang phổ kế).
+ Xung động ký (phép đo xung động kế).
1/ Phép đo sắc ký dựa trên cơ sở sự hấp thụ ánh sáng khác nhau của Oxyhemoglobin và Deoxyhemoglobin đối với ánh sáng đỏ (red light) có bước sóng 660nm và tia hồng ngoại (infrared light) có bước sóng 940nm.
2/ Phép đo xung động ký hoạt động dựa trên cơ sở độ hấp thu ánh sáng truyền qua mô thay đổi có tính chu kỳ do sự thay đổi thể tích máu giữa kỳ tâm thu và tâm trương.
Chính do phương pháp đo không xâm lấn, độ bão hòa oxy đo được qua SpO2 không chính xác bằng SaO2. Khi xuất hiện CO-Hb, MetHb, … thì SpO2 vẫn bình thường trong khi SaO2 giảm. Người ta gọi là SpO2 “cao bất thường” (falsely high).

Source: https://ylamsang.net/su-khac-nhau-giua-spo2-va-sao2/
Chi tiết hơn thì tham khảo tại link: https://www.howequipmentworks.com/pulse_oximeter/?fbclid=IwAR1W2nwb3cUECUCHRc7TXQaw3c4oS6shiu3oPUqKGoMCEG7OSO5dOlF2R50
* BẠN CÓ BIẾT:
1/ Hiệu ứng domino khi oxy gắn vào nhân heme:
Oxy gắn với nhân heme theo tính hiệp đồng (cooperativity), tức mỗi phân tử oxy gắn với một tiểu đơn vị polypeptide (subunit) của heme làm thay đổi cấu hình của 3 tiểu đơn vị còn lại: từ trạng thái căng (taut/tense) có ái lực thấp (T state) thành trạng thái thư giãn (relaxed) có ái lực cao (R-sate), qua đó làm quá trình bão hòa oxy của hemoglobin diễn ra với tốc độ cao.
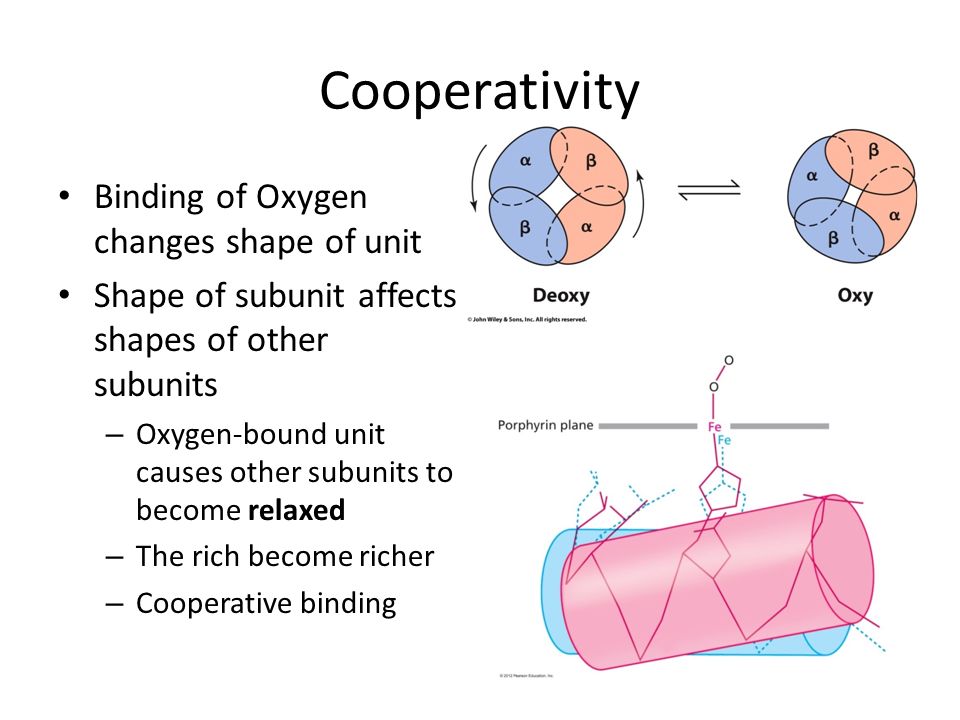
Source: https://slideplayer.com/slide/8198426/
Nếu không có tính phối hợp này, ta có thể thấy sự bão hòa oxy diễn ra kém hiệu quả hơn đáng kể:

Source: http://oregonstate.edu/instruct/bb450/fall14/lecture/hemoglobinoutline.html
2/ 2,3-DPG là một chất điều hòa dị lập thể (allosteric effector) của sự nhả oxy trong hồng cầu.
Do không có nhân cũng như ti thể, hồng cầu lấy năng lượng từ nguồn duy nhất là glucose. Đường phân của hồng cầu bao gồm cả 3 con đường: HDP yếm khí (tạo lactate), con đường tạo 2,3-DPG (2,3-DPG pathway) và HMP (tạo NADPH, H+ bảo vệ glutathion dạng bị khử).

Source: https://www.flickr.com/photos/130952279@N06/16822781642
2,3-DPG (2,3-Diphosphoglycerate) hoặc còn được gọi là 2,3-BPG (2,3-Biphosphoglycerate) là sản phẩm của một quá trình đường phân ở hồng cầu (2,3-DPG pathway) và là một trong những chất điều hòa quan trọng nhất của quá trình nhả oxy cho mô. Enzyme biphosphoglycerate mutase xúc tác quá trình chuyển 1,3-DPG thành 2,3-DPG.

Source: https://www.sciencedirect.com/topics/medicine-and-dentistry/2-3-bisphosphoglyceric-acid
Chất này thường được kích thích sản sinh ở các mô có phân áp oxy thấp (hoạt động chuyển hóa mạnh, pH thấp, …) và gắn vào hemoglobin ở khoảng trống giữa tiểu đơn vị beta 1 và beta 2. Giữa cấu trúc tích điện âm của 2,3-DPG (nhờ 2 gốc phosphate) và các amino acid tích điện dương trong 2 tiểu đơn vị polypeptide beta 1 và beta 2 (như lysine, histidine) sẽ hình thành lực hút tĩnh điện (electrostatic force).
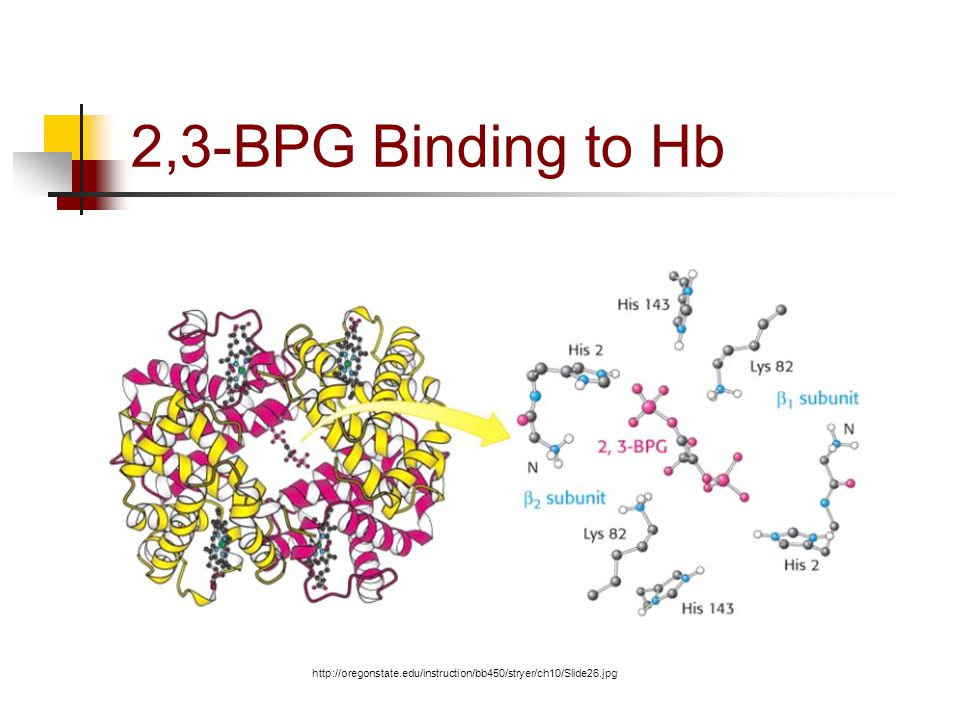
Source: https://slideplayer.com/slide/4463265/
Ở trên, ta biết rằng mỗi tiểu đơn vị của hemoglobin có nhân heme để gắn oxy, đồng thời khi oxy gắn vào một tiểu đơn vị thì nó sẽ tạo sự thay đổi cấu hình (conformational change). Sự thay đổi này làm thu hẹp khoảng không gian giữa tiểu đơn vị beta 1 và beta 2. Điều này đồng nghĩa 2,3-DPG chỉ có thể gắn vào deoxyhemoglobin. Đó là cách mà 2,3-DPG chuyển dịch đường cong phân ly oxy sang phải, làm tăng lượng oxy tự do cho mô. Các nguyên nhân khác gây hiệu ứng tương tự là pH thấp, nhiệt độ tăng (mô hoạt động mạnh).

3/ PaO2 liệu có thể lớn hơn 100mmHg?
Câu trả lời là được. Lưu ý rằng áp suất riêng phần của O2 trong máu động mạch là kết quả của sự trao đổi O2 tại giường mao mạch phế nang, với PO2 phế nang (hít vào bình thường) khoảng 100mmHg còn PvO2 (áp suất riêng phần của máu tĩnh mạch) vào khoảng 40mmHg. Như vậy, ở bệnh nhân thở oxy liều cao, PO2 phế nang có thể lên tới 300mmHg! Quá trình trao đổi O2 của lượng O2 này với O2 tĩnh mạch có thể dẫn đến PaO2 khoảng 150-200mmHg. Do đó PaO2>100mmHg ở bệnh nhân thở oxy liều cao là điều bình thường.
4/ Hiệu ứng Bohr và hiệu ứng Haldane:
Ta biết rằng, oxy đi từ phổi đến mô bằng 2 con đường, bao gồm hòa tan (dissolve) và gắn vào nhân heme của hemoglobin (HbO2). Ngược lại, CO2 đi từ mô đến phổi qua 3 con đường, bao gồm hòa tan (dissolve), thông qua HbH+ (tới phổi kết hợp với HCO3- tạo thành CO2) và gắn vào globin của hemoglobin (HbCOO-).
Như vậy, CO2/H+ có mối liên hệ với O2 trong việc gắn vào Hb và ngược lại.
Hiệu ứng Bohr đề cập đến vai trò của CO2 và H+ trong sự gắn O2 vào Hb. Theo đó, phân áp oxy hay H+ tăng (pH thấp) sẽ làm tăng phân li HbO2 thành Hb và O2.
Trong khi đó, hiệu ứng Haldane lại đề cập đến vai trò của O2 trong việc gắn CO2 và H+ vào Hb. Theo hiệu ứng này, sự khử oxy trong hemoglobin sẽ làm tăng khả năng chứa đựng carbonic của nó; ngược lại máu chứa nhiều oxy thì khả năng chứa đựng carbonic sẽ giảm đi.
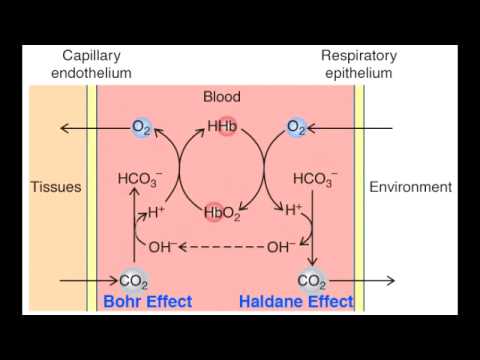
Source: https://www.youtube.com/watch?v=lSqKjMpdfV8
Ví dụ ở hình trên:
+ Ở thì hít vào, O2 đi qua biểu mô hô hấp chuyển HbH+ thành HbO2 và H+. Lượng H+ này tác dụng với HCO3-, tạo CO2 được thải ra môi trường ngoài. Đó là một trường hợp của hiệu ứng Haldane: máu chứa nhiều O2 làm khả năng chứa CO2 cũng như H+ giảm đi.
+ Ở mô, CO2 là sản phẩm của quá trình chuyển hóa. Khi được giải phóng khỏi mô, CO2 kết hợp với H2O tạo HCO3-, làm phân li HbO2 để có O2 hòa tan vào mô để cung cấp tiếp O2 cho quá trình chuyển hóa. Đó là một trường hợp của hiệu ứng Bohr: sự tăng CO2 (tương tự là H+) làm tăng sự nhả oxy từ HbO2.
Một ứng dụng lâm sàng: tăng CO2 (hypercapnia) ở bệnh nhân COPD dùng liệu pháp oxy (oxygen therapy).
1/ V/ Q mismatch: Vùng nhu mô phổi vốn ít được thông khí sẽ có hiện tượng co mạch máu tại chỗ do giảm O2 (hypoxic vasoconstriction). Cung cấp O2 có thể làm mất hiện tượng này, dẫn đến sự tái phân bố máu đến vùng nhu mô phổi kém thông khí => V/ Q mismatch => giảm đào thải CO2.
2/ Hiệu ứng Haldane: liệu pháp oxy làm tăng O2 máu => giảm deoxygenated hemoglobin => giảm khả năng vận chuyển CO2 của máu => tăng CO2.